- Як утворюються солі жорсткості
- Одиниці виміру
- Норми жорсткості
- Як обчислити жорсткість у домашніх умовах
- Вплив води
- Способи пом'якшення води
- Підсумок
Допоможіть розробці сайту, ділитися статтею з друзями!
Жорсткість води - один із найважливіших критеріїв, що визначають її споживчі властивості. Утворюючи нерозчинні мінеральні відкладення на внутрішній поверхні електроприладів та промислового обладнання, вона призводить до погіршення їх експлуатаційних характеристик. Для оцінки якості води встановлено допустимі межі показника.
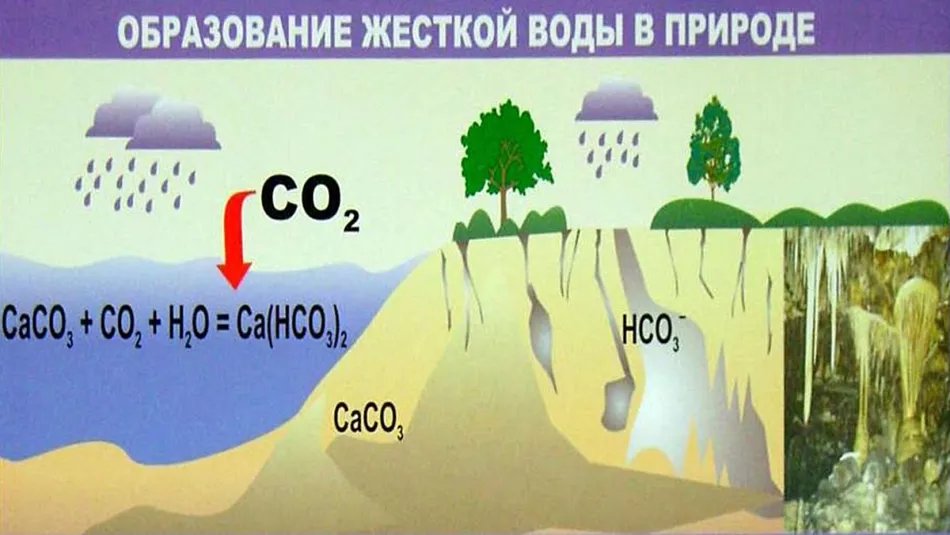
Як утворюються солі жорсткості
Вода - універсальний розчинник. Склад природних джерел формується в залежності від типу місцевості. Вода з розчиненим у ній вуглекислим газом проникає у ґрунт, проходить через товщі геологічних порід – гіпсу, доломіту, кальциту, розмиває їх, збагачуючись органічними та мінеральними речовинами, іонами металів.Вони становлять загальну мінералізацію води (TDS).
Серед них переважають катіони кальцію і магнію, їх сумарне значення дає загальну жорсткість води. Її поділяють на два види:
- тимчасову (карбонатну);
- постійну (некарбонатну).
Формула загальної жорсткості має вигляд:
Жо=[Ca2+] + [Mg2+]=Жк+ Жнк
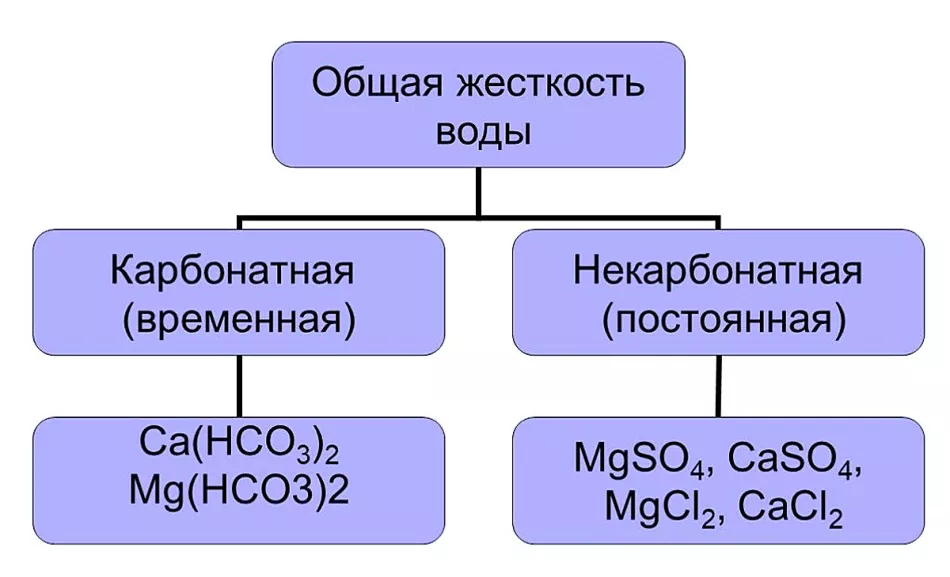
Карбонатна жорсткість обумовлена присутністю гідрокарбонатів Ca(HCO3)2і Mg(HCO3 )2Вони легко видаляються з розчину, утворюючи при кип'ятінні нерозчинний осад. Другий вид жорсткості визначає вміст воді розчинних солей, які неможливо видалити при нагріванні. Для усунення постійної жорсткості використовуються різні методи, про які розповімо далі у статті.
На відміну від підземних джерел поверхневі води містять менше солей, оскільки постійно розбавляються опадами, що випадають.Рівень жорсткості у яких - величина непостійна. Вона сягає граничних значень взимку, а період паводків знижується. У підземних водах цей показник більш стабільний.
Одиниці виміру
Концентрація солей вимірюється в міліграм еквівалентах на літр: 1 мг-екв/л=20,04 мг Са2+та 12,16 мг Мg+У міжнародній системі СІ показник чисельно виражається в молях на метр3(моль/м3). У нашій країні застосовуються градуси жорсткості, 1 ºЖ=1 мг-екв/л або 0,5 ммоль/л.
Градуси жорсткості використовуються і в інших країнах, але відрізняються числовими значеннями:
- німецький градус жорсткості 1ºdH=10 мг/л СаО або 7,194 мг/л MgO;
- французький градус 1ºfH=10 мг/л СаСО3;
- англійська 1 ºClark=14,254 мг/л СаСО3;
- американський 1 gpg=17,12 мг/л СаСО3.
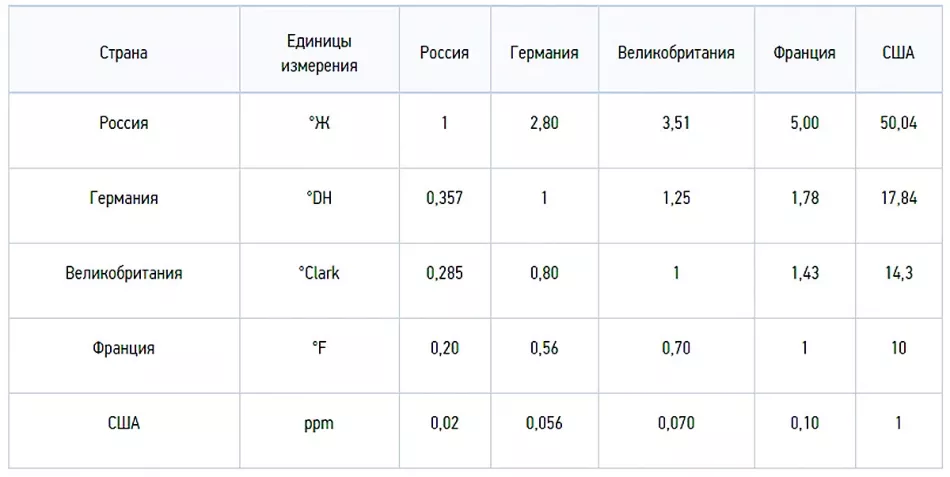
Для переходу в інші одиниці виміру зручніше використовувати ще одну американську одиницю - PPM (ППМ), що дорівнює 1 мг/л СаСО3. Звідси:
- 1ºdH=17,9 ppm;
- 1ºfH=10,0 ppm;
- 1 ºClark=14,25 ppm;
- 1º gpg=17,1 ppm;
- 1ºЖ=50,05 ppm.
Перевести ррm у зручні для нас градуси жорсткості ºЖ можна конвертером. Для переходу між градусами можна скористатися шкалою:
1 ºЖ=2,804 ºdH=3,5 ºClark=5,005 ºfH=2,924 gpg=50,05ppm.
Норми жорсткості
За параметром загальної жорсткості розрізняють воду:
- м'яку - до 4 ºЖ;
- середньої жорсткості - від 4 до 8 ºЖ;
- жорстку - понад 8 ºЖ.
Різноманітність природних умов не дозволяє встановити єдині норми жорсткості для всіх регіонів. Гранично допустима концентрація (ГДК) Са2+ варіюється в широких межах залежно від місцевих умов.
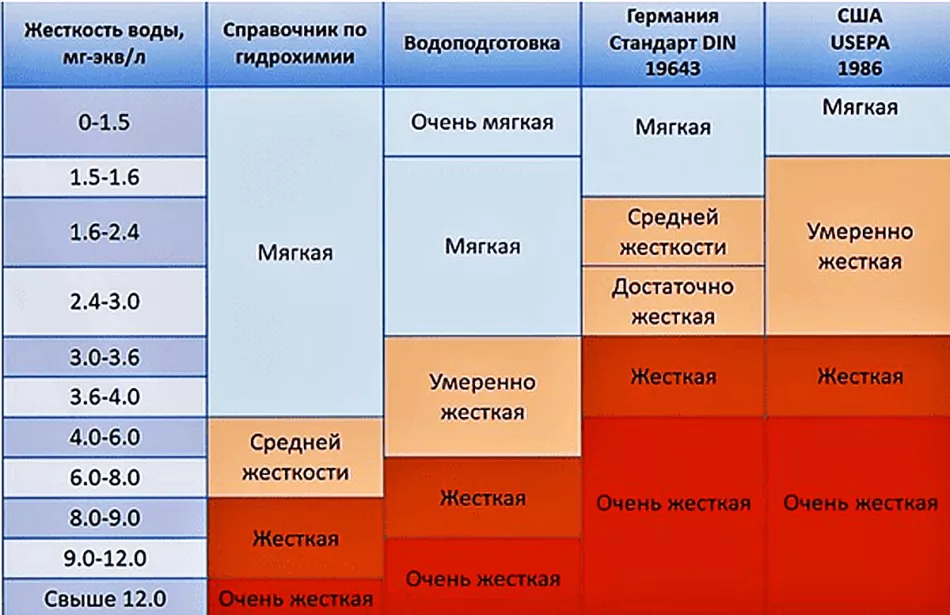
Однак стандарти питної води не дуже відрізняються від установок ВООЗ (Всесвітня організація охорони здоров'я). Як національний стандарт у нашій країні з 01.01.2014 діє ГОСТ 31954-2012. У ньому враховуються основні міжнародні нормативи щодо якості води та методів аналізу. Стандарт поширюється на всі підземні та поверхневі джерела.
Таблиця 1. Нормативні значення концентрацій кальцію та магнію в питній воді
| № | Норм. документ | Продукт | Са, мг/л | Mg, мг/л | Градуси, ºЖ |
|---|---|---|---|---|---|
| 1 | СанПін_2.1.4.1074-01, ГН_2.1.5.1315-03 | Питна вода | Не регламентується | Не регламентується | 7 |
| 2 | СанПін 2.1.4.1116-02 | Бутильована вода | 25-130 | 5 - 65 | 1,5-7 |
| 3 | Норми ВООЗ | Питна вода | 20-80 | 10 - 30 | Не пропонується |
Склад води залежно від призначення регламентується шкалою жорсткості:
- допустимий показник для водопровідної води - 300 ppm або 6 ºЖ;
- оптимальне значення для природних водойм - в межах 400 ррm або 8 ºЖ;
- гранично допустимий рівень жорсткості - 500 ppm, 10 ºЖ;
- концентрація солей, що становить небезпеку для життя - понад 500 ррм,>10 ºЖ.
Особливо суворі вимоги пред'являються до води, що подається в нагрівальні котли на електростанціях - показник загальної жорсткості не може перевищувати 0,05-0,1 мг-екв/л.
Як обчислити жорсткість у домашніх умовах
Підвищена жорсткість не виражається будь-якими зовнішніми ознаками - запахом, кольором, консистенцією. Про неї свідчать:
- утворюється накип на дні чайника;
- погане спінювання миючих засобів;
- білі розлучення на душовій лійці у ванній.

Точний склад води можна дізнатися лише за допомогою аналізу. Але і в домашніх умовах є простий спосіб визначити жорсткість водопровідної води з невеликою похибкою в 1-2 градуси.
Для експерименту знадобляться: шматок господарського мила, невеликий об'єм дистильованої води, електронні ваги, ємність, циліндрична склянка, лінійка.
Дрібно натерти 1 г господарського мила і розчинити його в 3-4 столових ложках злегка підігрітої дистильованої води. Якщо під рукою немає кухонних терезів, можна орієнтуватися на око - пів чайної ложки без верху.- У склянку з мильним розчином долити дистильованої води так, щоб висота стовпа рідини відповідала процентному вмісту жирних кислот, вказаному на бруску мила. Якщо 72%, то висота водяного стовпа має становити 72 мм від дна склянки, але не від поверхні столу.
- Набрати в ємність 0,5 л водопровідної води і, плавно помішуючи, вливати в неї тонким струменем мильний розчин. Спочатку у воді з'являться пластівці, бульбашки, потім – стійка біла піна. Вона свідчить про те, що вже пов'язані всі солі.
Обчислити кількість сантиметрів водного стовпа, перелитого в ємність, можна шляхом віднімання висоти мильного розчину, що залишився, від вихідного:
hп=hі- hо,
де:
- hп - висота стовпа перелитого розчину;
- hі - висота водного стовпа вихідного мильного розчину;
- hо - висота стовпа залишку мильного розчину.
Кожен сантиметр перелитого в ємність розчину відповідає 2ºdH. Значення збігаються з німецькою одиницею жорсткості. Наприклад, перелито зі склянки 4,6 см, що відповідає 9,2 dH.
Для перекладу отриманих результатів в мг-екв/л можна скористатися таблицею, а для точного результату - калькулятором.
| № | Градуси dH | Рівень жорсткості | Показник в мг-екв/л |
|---|---|---|---|
| 1 | 0 - 4 | Дуже м'яка | До 1,4 |
| 2 | 5 - 11 | М'яка | 1,8 - 4,0 |
| 3 | 12 - 22 | Середня | 4,3-8,0 |
| 4 | 22 - 34 | Жорстка | 8,0-12 |
| 5 | Більше 34 | Дуже жорстка | Вище 12 |
Отримати більш точний результат можна за допомогою електронних тестерів типу TDS-3. Вони роблять аналіз води на жорсткість та кислотність, виводячи результати на екран у вигляді РРМ або рН. Перетворити одиниці РРМ на ºЖ можна калькулятором.

Якщо ви хочете отримати докладний аналіз води у свердловині або колодязі, то це можна зробити набором «Свердловина-1».
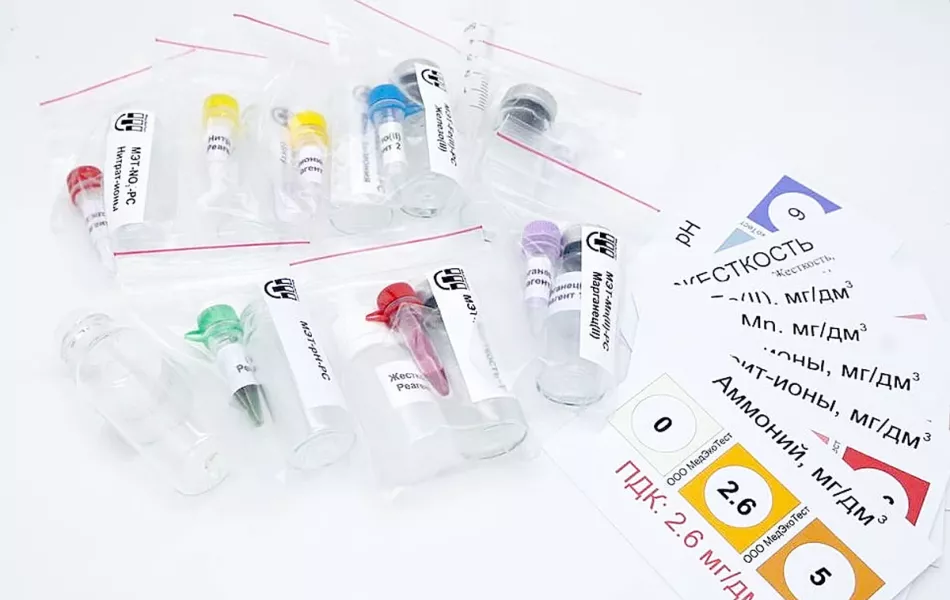
Ще один простий і недорогий спосіб визначити якість води - тест-смужки.

Вплив води
На організм людини
На сьогоднішній день немає серйозних досліджень, що підтверджують шкідливий вплив жорсткої води на живий організм. Але відомо, що тривале споживання води з підвищеним рівнем жорсткості сприяє розвитку сечокам'яної хвороби. Організм не встигає виводити надлишки мікроелементів, що призводить до появи сечових каменів, каменів у нирках та відкладень у суглобах.
Якість води має і гігієнічне значення. Мило, вступаючи в реакцію із солями кальцію та магнію, руйнує захисний шар шкіри, викликаючи роздратування чи алергію. Волосся стає сухим і ламким.
Одночасно з цим, кальцій і магній - важливі для життєдіяльності людини мікроелементи:
- денна норма кальцію становить 1000 мг;
- магнію - 400 мг.

Недолік цих елементів може викликати серйозні порушення в організмі. За дослідженнями ВООЗ відзначено, що споживання надмірно м'якої води призводить до вимивання солей з організму та зміни водно-сольового балансу. У регіонах із вживанням м'якої води зазначається:
- зростання серцево-судинних захворювань;
- зростання кількості переломів у дітей та зниження ваги новонароджених.
ВООЗ вказує, що присутність солей у воді слід вважати необхідною умовою для нормальної життєдіяльності організму.
На техніку
Солі жорсткості доставляють масу проблем, пов'язаних з використанням побутових приладів та промислового обладнання:
- шар накипу, що утворюється на стінках пральних та посудомийних машин, призводить до передчасної поломки;
- крани та душові лійки забиваються вапняним нальотом;
- недостатнє спінювання прального порошку веде до його перевитрати;
- покриті накипом труби і ТЕНи збільшують витрату електроенергії і виходять з ладу;

- випадають в осад солі зменшують прохідність труб у системах водопостачання, знижуючи напір води;
- нерозчинні з'єднання на стінках радіаторів стають потужним утеплювачем, знижуючи їх тепловіддачу.
Занадто м'яка вода негативно впливає на техніку, підвищуючи небезпеку корозії труб через низьку лужність. Тому необхідно підтримувати правильний баланс водно-сольового складу.
Способи пом'якшення води
Існують різні способи зниження жорсткості. Вибір визначається в залежності від вихідної якості води, її призначення та умов використання.Термічний метод
Кип'ячення - найпростіший і найдоступніший спосіб усунути карбонатну жорсткість. Він підходить для невеликих обсягів води, що використовуються для побутових потреб. Однак метод не усуває всі солі жорсткості, а посуд доведеться очищати від накипу.
Фільтрація
Нещодавно фільтр для пом'якшення води представляв значну установку. Сучасні технології та матеріали дозволили створити компактні системи очищення, що надають воді м'якість, що з легкістю поміщаються під мийкою на кухні. Змінні картриджі фільтрів, крім пом'якшення води, видаляють запахи та домішки. Правильний підбір фільтрів та своєчасна заміна гарантують якісне очищення води з водопроводу, свердловини чи колодязя. Однією із сучасних комплексних систем є фільтри «Бар'єр».

Хімічні способи
Для осадження солей жорсткості у воду додають спеціальні реагенти - гашене вапно, соду, поліфосфати. Метод ефективний для промислового застосування. Головний його недолік – у необхідності подальшої утилізації відходів. Вода після такої обробки непридатна для харчових цілей.
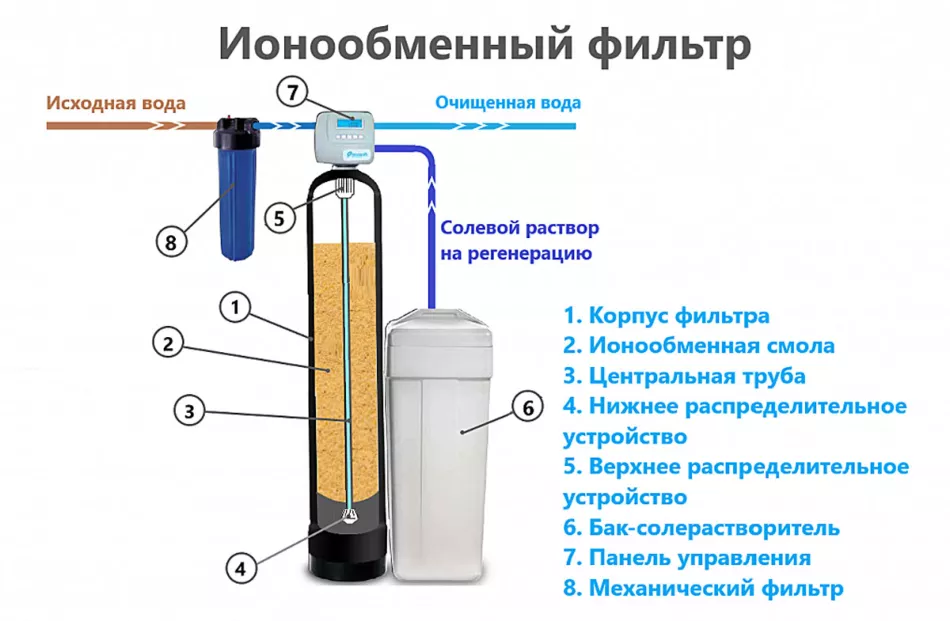
Іонний обмін
Фільтрація через іонообмінні смоли успішно використовується в промисловості.Принцип заснований на заміщенні катіонів лужноземельних металів іонами натрію та водню в колонці з дрібнозернистим засипанням. Для регенерації відпрацьованої смоли використовують розчин кухонної солі. При зміні рівня жорсткості води необхідне ручне коригування налаштувань.
Фізичні методи
В основу цих методів покладено процеси електродіалізу, дії ультразвуком, електромагнітних імпульсів. Солі жорсткості перетворюються на модифікований стан, при якому вони не кристалізуються в твердий осад, а утворюють нестійкі сполуки. Застосування ультразвукових і електромагнітних хвиль додатково сприяє відшарування вже наявного накипу.
Мембранний метод
Цей спосіб очищення має іншу назву - зворотний осмос. Вода під високим тиском пропускається через фільтр із мікроскопічними осередками і повністю очищається від хімічних домішок, завислих частинок, бактерій.Якість одержуваної води близька до дистильованої. Для її вживання потрібна додаткова мінералізація. Недолік методу його дорожнечі.

Підсумок
Оцінюючи якість води, важливо враховувати не тільки рівень жорсткості та ймовірність утворення накипу, але також корозійну здатність. Правильна оцінка дозволить підібрати ефективний комплекс заходів для водопідготовки.
